Cuando queremos detectar algún tipo de actividad enzimática en microscopía óptica se recurre a la histoquímica, que consiste en utilizar sustratos alternativos a los originales (ya sea de forma directa o por una reacción acoplada) para que dé algún tipo de pigmentación o coloración que pueda ser detectada por microscopía óptica, y si el cromógeno tiene carácter metálico o afinidad por éstos se puede detectar también mediante microscopía electrónica.
![F010620_2[1] F010620_2[1]](http://lh5.ggpht.com/_OoYppqQA93Q/S2gLYQXLOYI/AAAAAAAAAqc/WBZCe5rWY4s/F010620_2%5B1%5D_thumb%5B7%5D.jpg?imgmax=800) De entrada la histoquímica plantea ya una serie de problemas, porque si nuestro objetivo es diferenciar estructuras el tejido debe fijarse de manera que se conserve al máximo la estructura y en el caso de la microscopía electrónica la ultraestructura, pero muchas veces estos fijadores se basan en la formación de enlaces covalentes entre ciertos residuos de la cadena peptídica, como por ejemplo entre residuos de Lys en el caso de los aldehídos. Esto puede afectar a la actividad enzimática ya que los cruzamientos pueden alterar (o no) el centro activo y eliminar cualquier posibilidad de reacción dando lugar a un falso negativo. Lo más recomendable en la mayoría de los casos es recurrir a la bibliografía o poner a prueba tu propio protocolo, por que al fin y al cabo si nuestro enzima es capaz de soportar agresivos procedimientos de fijación e inclusión pero que conservan al máximo la estructura, ¿por qué no utilizarlos?.
De entrada la histoquímica plantea ya una serie de problemas, porque si nuestro objetivo es diferenciar estructuras el tejido debe fijarse de manera que se conserve al máximo la estructura y en el caso de la microscopía electrónica la ultraestructura, pero muchas veces estos fijadores se basan en la formación de enlaces covalentes entre ciertos residuos de la cadena peptídica, como por ejemplo entre residuos de Lys en el caso de los aldehídos. Esto puede afectar a la actividad enzimática ya que los cruzamientos pueden alterar (o no) el centro activo y eliminar cualquier posibilidad de reacción dando lugar a un falso negativo. Lo más recomendable en la mayoría de los casos es recurrir a la bibliografía o poner a prueba tu propio protocolo, por que al fin y al cabo si nuestro enzima es capaz de soportar agresivos procedimientos de fijación e inclusión pero que conservan al máximo la estructura, ¿por qué no utilizarlos?.
Soy consciente que el título trata también sobre genes repórter y ¿alguna relación tendrán con la histoquímica no? Pues si la tienen.
Los genes “repórter” o testigo, son genes que se utilizan para detectar la transcripción y traducción de otros genes que por su naturaleza no son visibles al microscopio., la relación que guardan con la histoquímica es que muchas veces el producto de este gen testigo es un enzima que se puede detectar con un sustrato cromogénico.
Hay que tener en cuenta que un buen gen testigo no debe estar presente en el organismo de estudio ya que así nos evitaremos falsos positivos, o bien si existe de forma endógena que este se pueda bloquear de forma específica. La utilización de un gen testigo requiere la manipulación del genoma, mediante técnicas de clonación al embrión o al propio zigoto se le debe incorporar el gen para su posterior expresión i revelado.
Un ejemplo de gen testigo bastante utilizado es el gen de la beta galactosidasa, es archiconocido (por el operón lac de E. coli), no está presente en la mayoría de los organismos de estudio y además tiene sustratos cromogénicos y fáciles de detectar en microscopía óptica, como por ejemplo el X-gal que por la ![thumb_albfig05b[1] thumb_albfig05b[1]](http://lh5.ggpht.com/_OoYppqQA93Q/S2gLaAykS_I/AAAAAAAAAqk/3RRORsicxtc/thumb_albfig05b%5B1%5D_thumb%5B7%5D.jpg?imgmax=800) actividad galactosidasa del enzima da lugar a un producto de color azul, si sois lectores asiduos del blog lo recordaréis por su uso en el vector puC de E. coli del que ya hablamos en otra entrada.
actividad galactosidasa del enzima da lugar a un producto de color azul, si sois lectores asiduos del blog lo recordaréis por su uso en el vector puC de E. coli del que ya hablamos en otra entrada.
Yo mismo he tenido la oportunidad de usar este gen testigo en prácticas de la asignatura de Técnicas Microscópicas. En este caso usamos el gen lacZ asociado al gen de la Mhc, la cadena pesada de miosina de D. melanogaster. Por tanto las moscas transgénicas expresaban un gen quimérico Mhc.-lacZ. en la misma ORF de transcripción de la miosina se transcribía el gen lac, dando lugar a betagalactosidasa en aquellos tejidos en donde se exprese este gen.
![untitled-1-copy[1] untitled-1-copy[1]](http://lh5.ggpht.com/_OoYppqQA93Q/S2gLdnJWz5I/AAAAAAAAAqs/HIi5jYwi9eQ/untitled-1-copy%5B1%5D_thumb%5B1%5D.jpg?imgmax=800) La cadena pesada de miosina tiene una elevada tasa de transcripción en el músculo, ya que forma parte de los sarcómeros y es la encargada de dar el golpe de potencia durante la contracción muscular.
La cadena pesada de miosina tiene una elevada tasa de transcripción en el músculo, ya que forma parte de los sarcómeros y es la encargada de dar el golpe de potencia durante la contracción muscular.
Para revelar el gen testigo en las moscas las anestesiamos y cortamos la cabeza y el abdomen, dejando tan sólo el tórax con el objetivo de ver los paquetes de musculatura esquelética que participan en el movimiento de las alas. Tras unos minutos de incubación con X-Gal lavamos con tampón y simplemente montamos sobre porta y cubre aplastando la mosca o haciendo lo que se conoce como squash. Hemos obtenido los siguientes resultados (si hacéis clic sobre la imagen se abrirá otra ventana con la imagen en tamaño original para más detalle):
1. Vista general del tórax:
El azul que se puede ver al final de las patas es el resultado del revelado con X-gal, la musculatura de las patas es la única que ha dado coloración azul y lo más probable es que la musculatura del tórax no haya quedado también en azul porque la solución de revelado no haya penetrado en su interior correctamente.
2. Detalle de los paquetes musculares de las patas:
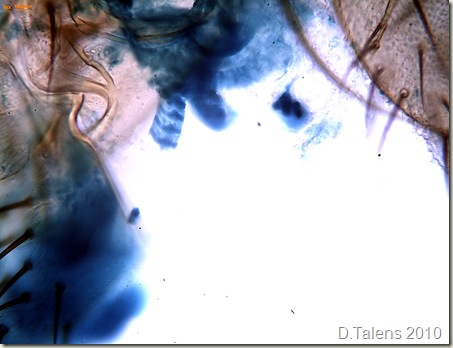
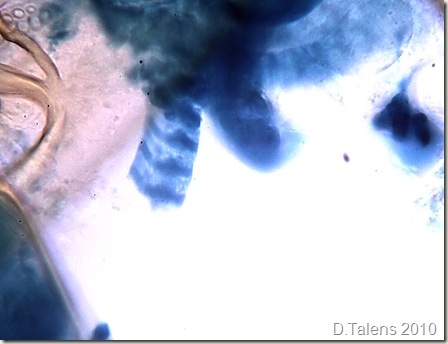
En esta captura a 40X ya se puede observar con más detalles los paquetes de fibras musculares incluso el bandeado que existe entre las zonas de solapamiento de actina-miosina en el sarcómero, que son más oscuras y las que sólo hay actina, que son las bandas claras. Aquí tenéis el detalle más ampliado:
3. Detalle del paquete de fibras:
Por cierto, ¿alguna vez no os habéis planteado por qué las moscas tienen tanta facilidad para adherirse a cualquier superficie? Creo que con esta foto tendréis la respuesta:
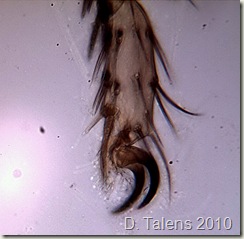 Con esas minúsculas uñas las moscas son capaces de adherirse a cualquier rugosidad de la superficie.
Con esas minúsculas uñas las moscas son capaces de adherirse a cualquier rugosidad de la superficie. Este ha sido tan sólo un ejemplo de uso de genes testigo pero hoy en día son la base fundamental en muchos campos de la investigación biológica ya que son los únicos capaces de mostrar a nuestros ojos lo que está ocurriendo en las células.

No hay comentarios :
Publicar un comentario