 |
| Adaptado de: Duran-Aniotz et al., 2013 |
Las β-glucosidasas son enzimas que juegan un papel crucial en la degradación de glucósidos, liberando moléculas de glucosa. BglA y BglB son ejemplos de estas enzimas y poseen una estructura común conocida como barril TIM (β/α)8, que es una de las estructuras proteicas más comunes en la naturaleza. En este estudio nos planteamos si éstas enzimas, procedentes de la bacteria Paenibacillus polymyxa, con diferentes estructura cuaternaria(BglA forma octámeros y BglB es un monómero), podrían servir como modelo de fibrilación. Son enzimas que se producen en grandes cantidades de forma heteróloga y esto permite obtener enzima suficiente para llevar a cabo los estudios.
 |
| Microscopía óptica de campo amplio de agregados de proteínas BglB y BglA utilizando microscopía de contraste de interferencia diferencial Nomarski (DIC/N) o iluminación de epifluorescencia después de tinción con ThT o Rojo Congo. Panel (A): BglA, pH 7.0, 65 °C (DIC/N). Paneles (B–D): BglB, pH 3.0, 45 °C (ThT). Panel (E): BglB, pH 3.0, 45 °C (DIC/N). Panel (F): BglB, pH 3.0, 45 °C (CR). Barra de escala: 20 µm en los paneles (A,B); 5 µm en los paneles (C–F). De: Rodriguez-López et al., (2024) |
En este caso se analiza cómo estas enzimas forman fibras amiloides bajo diferentes condiciones de pH y temperatura. Utilizando técnicas como la espectroscopía de fluorescencia, la microscopía óptica de campo amplio, la microscopía confocal y la microscopía electrónica de barrido de emisión de campo, los investigadores encontraron que ambas enzimas pueden fibrilar en un amplio rango de condiciones, especialmente en pH ácido (3-4) y temperaturas entre 45 y 65 °C. Algunas de estas condiciones también se pueden dar de forma puntual en nuestro organismo, debido a diferentes tipos de estrés celular, que de forma similar podrían inducir la formación de fibras en el organismo. Imaginaos el impacto que puede tener la formación de las fibras que vemos en microscopía electrónica en los espacios intercelulares o dentro de las propias células. A mi me recuerda al cuento de la habichuela mágica y de cómo las raices y los tallos destrozaban todo por donde pasaban.
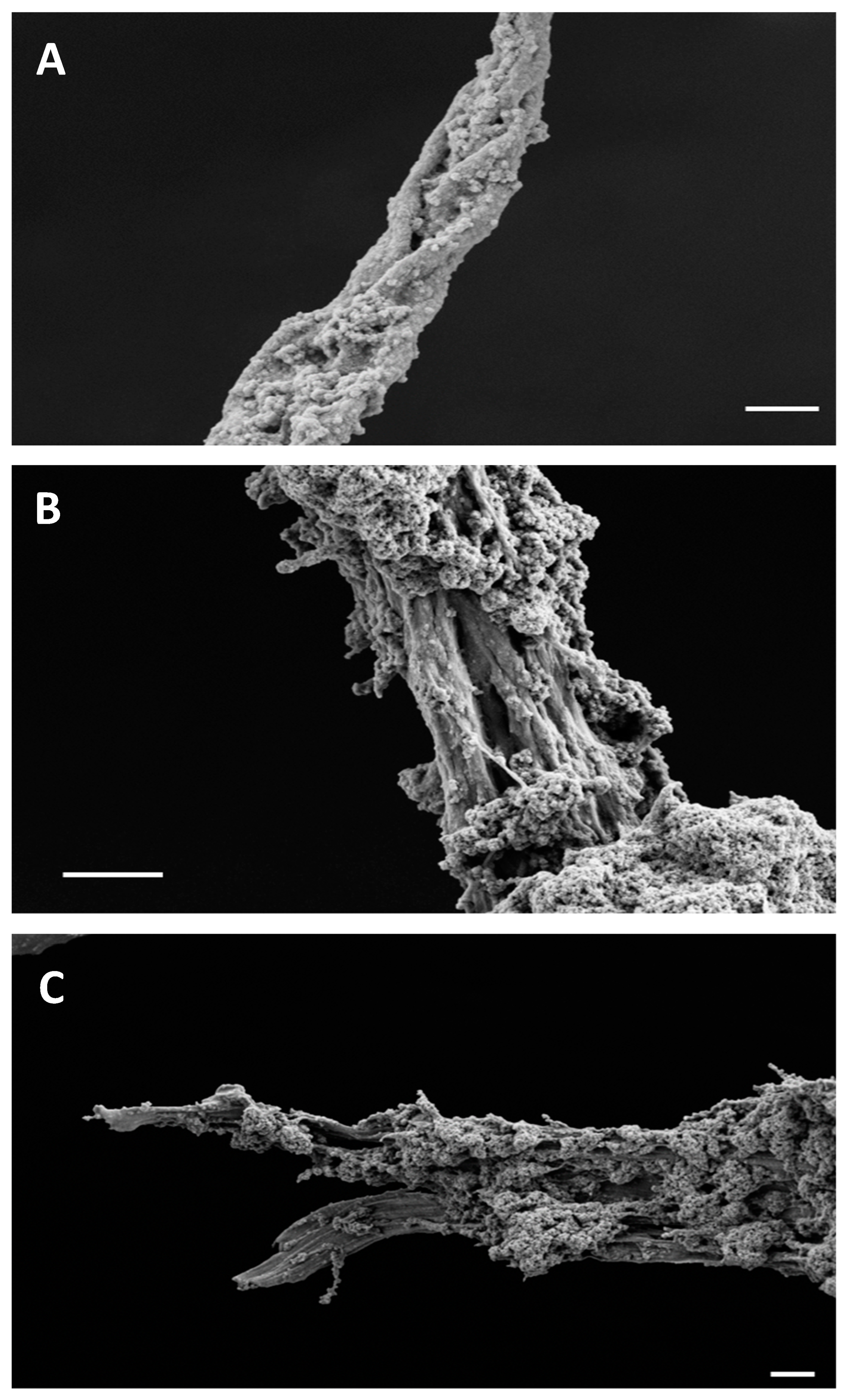 |
| Imágenes de microscopía electrónica de barrido de emisión de campo (FESEM) de fibras amiloides de BglB (paneles (A,B)) y BglA (panel (C)). Las muestras de proteína (1 mg/mL) fueron incubadas a pH 3 y temperatura ambiente durante 96 horas. Barra de escala: 1 µm (panel (A)), 2 µm (paneles (B,C)). De: Rodriguez-López et al., (2024) |
Este estudio tiene importancia porque sugiere que la fibrilación amiloide es un fenómeno común que puede ocurrir en muchas proteínas bajo condiciones que alteran su conformación nativa. El hallazgo de que tanto BglA como BglB pueden formar fibras amiloides refuerza la idea de que este proceso es impulsado por una transición de una estructura secundaria de α-hélice a una β-hoja. Comprender este proceso es crucial para el desarrollo de terapias que puedan inhibir la formación de estos agregados y tratar enfermedades amiloides.
Por ello, la investigación sobre la fibrilación en las β-glucosidasas BglA y BglB puede proporcionar una visión valiosa sobre los mecanismos de formación de dichas fibras. Al demostrar que la fibrilación puede inducirse en proteínas con estructuras comunes bajo condiciones específicas, este estudio allana el camino para futuras investigaciones y el desarrollo de tratamientos contra enfermedades relacionadas con depósitos de proteínas, utilizando este modelo como base de cribado de distintos fármacos que pudiesen prevenir su formación.
Os dejo la referencia por si queréis consultar el artículo con más calma y detalle:
Rodríguez-López, M.A.; Coll-Marqués, J.M.; Talens-Perales, D.; Marín-Navarro, J.; Polaina, J.; Vázquez-Contreras, E. Analysis of Amyloid Fibrillation of Two Family 1 Glycoside Hydrolases. Int. J. Mol. Sci. 2024, 25, 8536. https://doi.org/10.3390/ijms25158536.

No hay comentarios :
Publicar un comentario