En algunas entradas anteriores ya os he nombrado al ATP como moneda de intercambio de energía en los seres vivos, he explicado su naturaleza...Pero, ¿De dónde proviene este ATP? ¿Cómo se obtiene este ATP de los alimentos?
Durante la metabolización de los nutrientes hay reacciones que permiten la transferencia de grupos fosfatos al ADP y convertirlo en ATP. Pero gran parte del ATP se obtiene gracias a la cadena de transporte electrónico, y aquí es donde me gustaría centrarme y contaros algo muy fascinante.
Un ejemplo de obtención de energía eléctrica en el caso de los humanos son las centrales térmicas. En estas centrales se realiza la combustión de carbón o petróleo para calentar agua y crear vapor que posteriormente hará girar unas turbinas conectadas a unos generadores que convertirán la energía térmica en mecánica y posteriormente en electricidad que llegará a cada uno de los enchufes de nuestras casas. En este caso la electricidad sería la moneda de intercanvio de energía común, como el caso de ATP en los organismos.
¿Por tanto poseen los organismos algún tipo de "central térmica "que transforme la energía que se obtiene de los alimentos en ATP? En efecto, las células eucariotas poseen varias "centrales térmicas" en su interior, y el concepto de funcionamiento es algo similar.
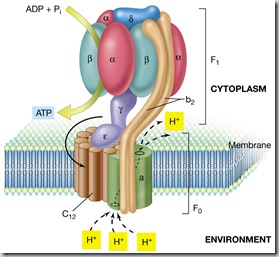
En el caso de las células estas centrales se llaman mitocondrias, y como las centrales poseen algo similar a los generadores, a esas turbinas de rotación impulsadas a vapor, el complejo ATP-sintasa, sólo que en lugar de vapor usa como impulsor de movimiento un gradiente de protones.
La ATP sintasa está situada en la membrana interna de las mitocondrias (también existen en los cloroplastos pero esto mejor para otra entrada)
Esta compuesta por dos complejos, el complejo F0 que es el complejo transmembrana y el complejo F1 situado mirando hacia la matriz mitocondrial.
Cada complejo esta formado por diferentes subunidades protéicas, en el complejo transmembrana se encuentra el canal para los protones, mientras que en el complejo F1 encontramos 5 tipos de subunidades a, b, g, d y e en donde se encuentran los tres sitios catalíticos, en concreto en las tres subunidades beta, en donde va a producirse la reacción ADP + Pi >>>>>>> ATP.
El mecanismo de funcionamiento es como el de un auténtico generador. Existe una diferencia de gradiente de protones entre el espacio intermembrana de la mitocondria y la matriz mitocondrial. Este gradiente provoca el paso de protones a través del complejo F0 de la ATP sintasa. Este paso de los protones provoca un giro de las subunidades c de la porción F0, este giro va a ser transmitido al eje gamma. Este eje interacciona con las subunidades catalíticas de la porción F1, produciendo cambios conformacionales en las subunidades proteicas disminuyendo la energía de activación de la reacción que transforma el ADP a ATP. Este mecanismo de la catálisis rotacional fue propuesto por Paul Boyer que fue Premio Nobel en 1997 gracias a este descubrimiento.
Por su puesto que este mecanismo no es tan simple como lo explico aquí, es mucho más complejo y tiene muchos más detalles, pero no creo que sea conveniente describir aquí todos esos detalles porque no llegarían a todos mis lectores, que no proceden todos del campo de la biología.
Aquí os dejo con un vídeo que permite entender mejor lo que he comentado en la entrada:


![causas_ppal[1]](http://lh4.ggpht.com/tapeda/SIG9h88j63I/AAAAAAAAAGc/E-o94io2tNQ/causas_ppal%5B1%5D_thumb%5B1%5D.jpg?imgmax=800)