A la hora de combatir una plaga, el control químico es una de las soluciones que se emplean día a día en muchos países. Hay otros muchos tipos de controles como biológico, parabiológico, microbiano, físico, mecánico, genético, integrado… pero el post de hoy va dedicado a destacar algunos aspectos del control químico.

Adquirió una gran importancia cuando los humanos pasamos de tener un huertecito con varios tipos de cultivos a tener un campo de mayores dimensiones y monocultivo, fue en este momento cuando entra en auge la utilización de plaguicidas ya que el campo monocultivo se convierte en blanco de especies plaga sin prácticamente competidores.
No sería hasta el siglo XVIII cuando comienza a investigarse sobre la fenología de las especies que causan daño ya que cuando no se conoce bien el ciclo, se intenta matar a la forma adulta y sin embargo es posible que acabar con las formas inmaduras sea mucho más sencillo. Fue en esta época cuando aparecen los primeros pulverizadores y se inventan los equipos de pulverización aérea, además se descubren sustancias naturales como la nicotina, un potente neurotóxico.
Ya en el siglo XIX se descubre el DDT y dados sus numerosos efectos secundarios se retira más tarde. De este modo surgen los plaguicidas actuales, más específicos y por tanto destinados a especies muy concretas.
La eficacia del control químico, depende de factores asociados a la fenología
De este modo, al igual que para los otros tipos de controles, habrá que saber también sus efectos sobre la fauna útil (como son parasitoides, depredadores, polinizadores…), las consecuencias que su aplicación tiene para la salud humana a corto, medio y largo plazo, los problemas de resistencia que puedan surgir y la presencia de residuos que puedan quedar en la atmósfera o en los alimentos que ingerimos, su bioacumulación…
En definitiva, se trata de un control rápido, bastante efectivo en muchos casos y no extraordinariamente caro, aunque eso sí, hay que tener en cuenta todos los problemas que pueda acarrear.






![intolerante-a-la-lactosa[1] intolerante-a-la-lactosa[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjep45J7hErLzWamHcFRrZzje-Low7KcB5affG5juB6qiK66ESzp7AE4EQ2IXKDOPdk4LyMyjy-UwjeLiL8YtwMK-9RPD4DKshNyqkQeY38algNy6jHv_Jd85ygftPuZHwx3dUOKzyTuZlu/?imgmax=800)

![lactose_intolerance[1] lactose_intolerance[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgUFPZTf7Gfd-5i8by8DLHI_FMwtElTkc3lqUdLMhLTrOBOaePgpqSAoJtkMD2eSqfPi6K-F0dUKCdpNQt9S7Pr8u3447gbUs7r0LlnJUnmCmZpS-N5MSnFvAFs78cFZw0uI8qV8Pxk0Ct9/?imgmax=800)








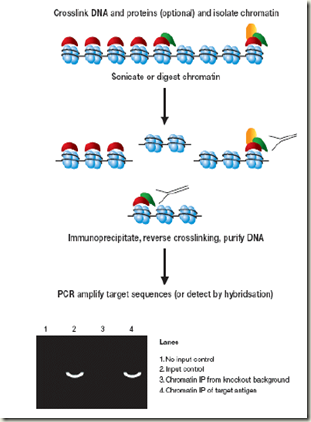



![SRP_model[1] SRP_model[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhTL4WfzWRQZXxfSy6GbajzpvYmgrr4y-yILf940OqzzSUtPfO_R8bBhMhd_sLFrYm0m6pr1t-3jubyn9io0Cs-9V_tRlQcJbIXDWj-JO-vPr4v8PeY25B4rcx3zJp8Wsb6GkOC6cAJUr3P/?imgmax=800)