Ayer estuvimos hablando de la estructura de GroEl y de los detalles de cada una de sus subunidades. Su funcionamiento no tiene ningún desperdicio.
El mecanismo funcional de GroEL y de GroES se podría resumir en cinco pasos:
1) Los residuos hidrofóbicos que recubren la cavidad de cada anillo de GroEL funcionan como un imán que une y reconoce todos los residuos hidrofóbicos que se encuentran a su alrededor y los une. Esta es una buena técnica para seleccionar las proteínas que se van a unir, porque si una proteína tiene los residuos hidrofóbicos en la parte externa quiere decir que no esta plegada correctamente ya que esta situación es desfavorable energéticamente. En estos casos GroEL tendría afinidad por este tipo de proteínas y se uniría a ellas.
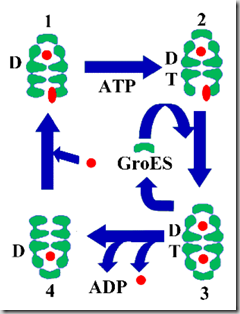 2) El ATP se une a su sitio de unión en el dominio ecuatorial de monómero de GroEL. La unión desencadena cambios conformacionales en la chaperonina. Además existe cooperatividad positiva entre los monómeros de un mismo anillo y cooperatividad negativa entre las subunidades de los dos anillos, de manera que una vez que la molécula de ATP se une a un monómero de los anillos y desencadena la unión inmediata de moléculas de ATP a las otras seis subunidades del mismo anillo, se impide la unión de ATP a las siete subunidades del otro anillo. Como hemos descrito en la parte de estructura, la unión del ATP produce un cambio conformacional que permite la unión de la cochaperonina GroES.
2) El ATP se une a su sitio de unión en el dominio ecuatorial de monómero de GroEL. La unión desencadena cambios conformacionales en la chaperonina. Además existe cooperatividad positiva entre los monómeros de un mismo anillo y cooperatividad negativa entre las subunidades de los dos anillos, de manera que una vez que la molécula de ATP se une a un monómero de los anillos y desencadena la unión inmediata de moléculas de ATP a las otras seis subunidades del mismo anillo, se impide la unión de ATP a las siete subunidades del otro anillo. Como hemos descrito en la parte de estructura, la unión del ATP produce un cambio conformacional que permite la unión de la cochaperonina GroES.
3) La unión del ATP provoca una apertura de la cavidad dentro del anillo y, por otra parte, GroES sella la cavidad donde se va a producir el fenómeno más importante, el plegamiento de la proteína. Los residuos hidrofóbicos, que hasta ahora interaccionaban con el polipéptido, lo hacen ahora con el lazo desordenado de GroES. El cambio conformacional producido por la cochaperonina hace que todos los residuos hidrofóbicos y cargados, que se exponían en la superficie interior de la cavidad, cambien de posición y dirección y queden expuestos residuos hidrofílicos. Una vez el polipéptido ha sido encerrado en estas condiciones, libre de interacciones no deseadas que acechan en el exterior, y en una cavidad mucho más grande que en el momento de unión, a causa de los cambios conformacionales, el polipéptido ya puede intentar plegarse por sí mismo, utilizando la información codificada en su secuencia (estructura primaria).
4) Las moléculas de ATP unidas a todas las subunidades del anillo se hidrolizan. La hidrólisis del nucleótido, además de relajar la unión de GroES a GroEL en ese anillo, permite que otra molécula de GroES se una al segundo anillo, formando un complejo simétrico.
5) La formación del complejo simétrico no es muy estable, porque la unión de GroES al segundo anillo induce la liberación de la cochaperonina del primer anillo y la salida al exterior del polipéptido encerrado. El primer anillo está ya dispuesto para recibir otro polipéptido desnaturalizado que se encuentre en su entorno.
Si leemos detenidamente el mecanismo, podemos compararlo con un motor de dos tiempos, con un motor de dos cilindros (los dos anillos) en el que cada uno de ellos se encuentra en cada momento en posiciones diferentes del ciclo.
Mientras un anillo está liberando la cochaperonina y por tanto el polipéptido encerrado, el otro se está uniendo otra cochaperonina.
En este paralelismo con un motor de dos cilindros el ATP funcionaría como combustible, gracias al cual el ciclo se mantiene en funcionamiento indefinidamente.
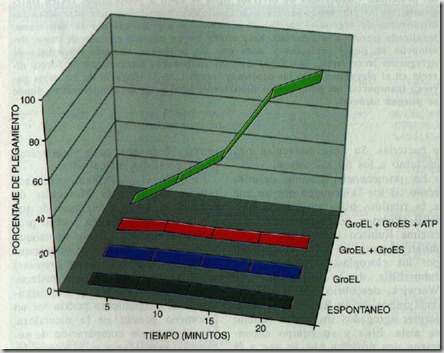
Si observamos la siguiente gráfica vemos que el porcentaje de plegamiento de una proteína desnaturalizada aumenta al máximo en un medio en que esta presente GroEl + GroEs + ATP. Se comprueba que tan solo la presencia de estos tres factores permite el plegamiento de la proteína al 100%.
¿No os parece curioso que otras proteínas ayuden a plegarse a otras proteínas? Esta es una muestra de su elevado nivel de importancia en cualquier ser vivo.

No hay comentarios :
Publicar un comentario