Después de un día de merecido descanso dominical seguimos donde lo dejamos.
Hablamos de las chaperonas, explicamos brevemente su ciclo y dejamos el tema de las chaperoninas para hoy.
Recordemos que las chaperoninas hace referencia a un tipo de chaperonas que aportan una cavidad, un espacio físico, en donde se puede producir el plegamiento de la proteína, aislada del entorno tan agreste y salvaje como es el citoplasma celular.
Son estructuras protéicas (y perdonen que me desvíe de la objetividad) IMPRESIONANTES, auténticas obras de nano-arquitectura creadas por la propia naturaleza, y si no fijaros en estas imágenes de la chaperonina GroEl:
Si pasáis el cursor por encima de la presentación una lente os ampliará el contenido.
Como veis esta estructura multiprotéica aporta un espacio en donde la proteína se puede plegar fuera del alcance de otras moléculas que haya "pululando" por el citosol. Hay que destacar que en las fotos aparece el complejo GroEl -GroEs. GroEs es la cochaperonina de GroEl, pero la estructura real de GroEl es la de la figura (a) y (b) que aparece en la foto con fondo blanco (recordad que podéis parar la presentación con el pause situado en la pare inferior izquierda)
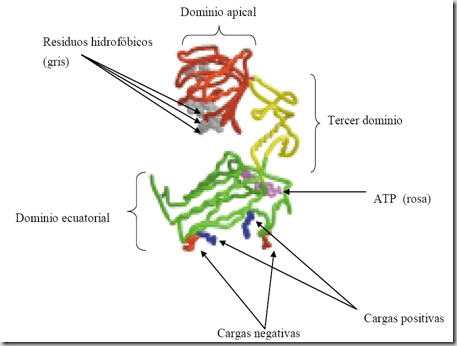
Es una gran complejo multiprotéico pero compuesto por 14 subunidades, y todas ellas poseen un dominio ecuatorial, donde encontramos la mayoría de los aminoácidos responsables de la interacción con las subunidades del mismo anillo y todos los responsables de la interacción con las subunidades del otro anillo. Reside en ese dominio la zona de unión a una molécula de ATP que es decisiva para el mantenimiento del ciclo del funcionamiento de la chaperonina, el ATP se une a la tirosina que ocupa la posición 447. En la base de este dominio encontramos residuos cargados negativamente y residuos cargados positivamente que van a participar en la unión de los dos anillos que conforman el complejo GroEL.
Encontramos un segundo dominio, el apical, que forma el techo de la cavidad del anillo. En la boca de la cavidad se alojan una serie de aminoácidos hidrófobos que estarán implicados en la unión de la proteína que va a ser plegada, así como con la unión del GroES. Finalmente el tercer dominio pone en contacto el dominio ecuatorial con el apical y a modo de bisagra que permite los movimientos que se producen durante el ciclo de funcionamiento.
La siguiente imagen muestra la descripción de los tres dominios existentes en GroEL:
El conjunto de estas subunidades forman el complejo que antes hemos visto en las imágenes de arriba. ¿Pero cómo funciona? Mejor lo dejamos para otro día ¿no?

No hay comentarios :
Publicar un comentario